نجاح زراعة كلى الخنازير في البشر يقترب أكثر من المتوقع
فهم التفاعلات المناعية في عمليات زرع أعضاء من الخنازير إلى البشر
نجح باحثون مؤخرًا في تحديد الخرائط التفصيلية لكيفية تفاعل الخلايا المناعية البشرية مع أنسجة الكلى المزروعة من الخنازير، معتمدين على تقنيات تصوير جزيئي مكاني متطورة. يأتي هذا التقدم في إطار جهود التغلب على تحدي رفض الجهاز المناعي للأعضاء المزروعة، والذي يمثل العقبة الأكبر أمام تطبيق زراعة الأعضاء من الخنازير المعدلة وراثيًا على نطاق واسع.
الاستجابة المناعية وزمنها الحاسم
- تم تحديد علامات جزيئية مبكرة تشير إلى بدء الرفض، ظهرت في اليوم العاشر بعد الزرع، وبلغت ذروتها في اليوم الثالث والثلاثين.
- هذه النتائج تؤكد أن الرفض لا يبدأ بسرعة فحسب، بل يتطور على مدة زمنية يمكن التدخل خلالها علاجياً.
- البحث استمر لمدة 61 يومًا بعد الزرع، ما سمح بتحديد “نافذة زمنية حرجة” يمكن خلالها تنفيذ تدخلات علاجية فعالة لمنع الرفض.
آليات الرفض المناعي
يشمل رفض الأعضاء المزروعة آليتين رئيسيتين:
- الرفض بواسطة الخلايا التائية: حيث تتعرف الخلايا اللمفاوية التائية على المستضدات الغريبة على العضو وتهاجمه مترة تلف الأنسجة.
- الرفض بواسطة الأجسام المضادة: حيث تتكون أجسام مضادة ضد مستضدات المتبرع، وتلتصق ببطانة الأوعية الدموية مسببة تنشيط الجهاز المناعي وتلف العضو.
التقدم في تطبيقات زرع الأعضاء البشرية
- تبدأ قريبًا أول تجارب سريرية لزرع كلى من خنازير معدلة وراثيًا في الولايات المتحدة، ضمن جهود لتحسين تفاعل الأعضاء المزروعة وتقليل رفض الجسم المناعي.
- حصلت الهيئات التنظيمية على الموافقات اللازمة، وتشمل التعديلات الجينية إضافة جينات بشرية وتعطيل جينات أخرى من الخنزير، بهدف زيادة التوافق وتقليل احتمالية الرفض.
قصص النجاح والتحديات المستقبلية
من أبرز الحالات:
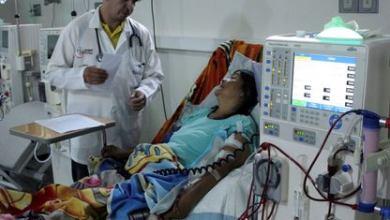
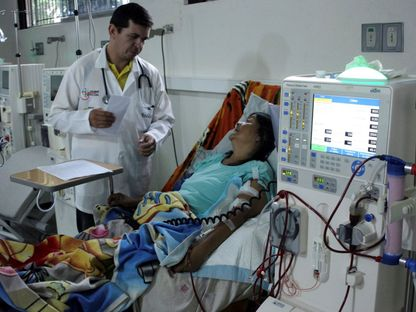
- في 16 مارس 2024، تلقى ريتشارد سلايمان، مصاب بالفشل الكلوي، أول كلية من خنزير معدل وراثيًا في مستشفى ماساتشوستس، وظهرت الوظيفة بشكل جيد قبل أن توفي بعد شهرين، مع تأكيد أن السبب لم يكن في الكلية.
- وفي 25 نوفمبر من نفس العام، تلقت توانا لوني، امرأة من ألاباما، كلية استمرت لمدة 130 يوماً قبل أن يتم إزالتها بسبب رفض حاد.
تطوير فهم التفاعل المناعي وتحسين العلاج
توفر الدراسة خريطة مفصلة للتفاعل بين الخلايا المناعية البشرية وأنسجة الخنزير المزروعة، مع تحديد أنماط تعبير الجينات وسلوك خلايا الجهاز المناعي، خاصة الخلايا البلعمية الكبيرة والخلايا النخاعية، والتي كانت الأكثر انتشارًا وتلعب دورًا رئيسيًا في عمليات الرفض المناعي.
هذه النتائج تفتح المجال لتطوير بروتوكولات علاجية موجهة تستهدف التفاعلات المناعية في مراحلها الأولى، بهدف تعطيل عملية الرفض وتقليل خطر فقدان الأعضاء المزروعة.
أزمة نقص الأعضاء العالمية وإمكانات الحلول البديلة
بالنظر إلى النقص الحاد في الأعضاء البشرية المتاحة، فإن زراعة الأعضاء من الخنازير المعدلة وراثيًا تمثل أملًا واعدًا لسد الفجوة، خاصة أن الطلب يتجاوز بكثير العرض المتاح.
وفي الولايات المتحدة، ينتظر أكثر من 100 ألف شخص عمليات زرع، ومعظمهم من مرضى الكلى، حيث يحتاج 86% منهم إلى كلية جديدة. وعلى الرغم من زيادة نشاط عمليات الزراعة في 2024، فإن الفجوة تبقى كبيرة، مع توقع استمرار تزايد الأولويات على مستوى العالم.
بالإضافة إلى ذلك، تشير التقديرات إلى أن حوالي 172 ألف عملية زرع قد أُجريت في 2023، لكن هذا يمثل أقل من 10% من الاحتياجات الحقيقية، مما يعزز الحاجة إلى استثمارات وبحث مستمر في تطوير الحلول المبتكرة.
آفاق المستقبل والتحديات
بينما يمثل فهم التفاعل المناعي وتطوير التقنيات المعدلة وراثيًا خطوة هامة، فإن اعتماد هذه الحلول بشكل روتيني يتطلب سنوات من التجارب المثبتة، وكذلك موافقات تنظيمية صارمة لضمان السلامة والأمان.
يأمل الباحثون في أن يؤدي هذا التقدم إلى جعل زراعة أعضاء الخنازير خياراً علاجيًا أساسيًا خلال عقد من الزمن، مما قد يُحدث ثورة في ميدان زراعة الأعضاء ويخفف من معاناة العديد من المرضى حول العالم.